Intento integrar en este espacio informes, datos, opiniones, sobre el tratamiento de la Leucemia Mielóide Crónica en particular y del Cáncer en general y compartir las experiencias de vida, discutir los condicionantes socioculturales y medioambientales que determinan los tratamiento que realizan los pacientes. Aspiro a generar un espacio de comunicación con todos aquellos que como yo, realicen tratamientos por enfermedades graves. Sin pretensiones autoreferenciales, me dispongo a compartir con pacientes, familiares y médicos, la palabra, que acompañe este azaroso recorrido.
Transito este tiempo con la enfermedad Leucemia Mielóide Crónica, Cromosoma Ph.+.
miércoles, 24 de marzo de 2010
domingo, 21 de marzo de 2010
Sitio web, de una creatividad distintiva, que ofrece a pacientes, familiares y voluntarios, información clara y adaptada a sus necesidades para facilitar la interacción con el sistema sanitario
Se trata de un proyecto que pretende guiar, a quien naufraga por la enfermedad, hacia distintos puertos, donde hallarán (por medio de recursos audiovisuales y educativos) información que le ayude en el proceso de adaptación a los tratamientos y sus efectos colaterales; y a las consecuencias que la enfermedad ocasiona, a nivel psico-emocional, espiritual, familiar y social.
Si ingresas al sitio podrás detener tu naufragio en los puertos que permitirán
1º Puerto: Entender la enfermedadInformación adaptada y sensible sobre el cáncer, el impacto que produce en nuestra vida.
2º Puerto: Conocer el sistema sanitario
Puede encontrar información acerca de las distintas unidades que se pueden encontrar en un hospital y sobre los distintos profesionales que componen el equipo de atención.
3º Puerto: Adaptarse a la enfermedad
Se incluyen en este puerto algunos métodos y técnicas para sobrellevar los efectos derivados de los tratamientos.
4º Puerto: Volver a la vida normal
Se describe la importancia del autocuidado y las implicancias de la reincorporación al mundo, social y laboral.
5º Puerto: Ayudar a los demás
sábado, 20 de marzo de 2010
Academia Nacional de Medicina Buenos Aires, 6-8 junio 2007
La leucemia mieloide crónica (LMC) es un desorden hematológico clonal que representa el 15% de las leucemias del adulto y afecta a 1-2 personas por cada 100.000 habitantes
Simposio Internacional
NUEVAS PERSPECTIVAS EN ONCOLOGIA
Academia Nacional de Medicina
Buenos Aires, 6-8 junio 2007
jueves, 18 de marzo de 2010
Hago mías, tus palabras Miguel Delibes... En contra de todos los mensajes optimistas, los inconscientes, los autoengaños
"Vivir pegado a un cáncer o a su posibilidad es no vivir... "
Miguel Delibes
"La operación de cáncer me quitó el cáncer, es cierto, pero también otras cosas importantes: memoria, orden mental, capacidad de concentración, hematíes, dioptrías, oído, etc. En suma, en el quirófano entró un hombre inteligente enfermo y salió un lerdo sano".
"Uno se convierte en un paciente sumiso que obedece, pero la cabeza no le sirve de nada. Durante más de diez años he sido esclavo de la enfermedad sin padecerla, o lo que es lo mismo, de sus achaques"
"Uno se convierte en un paciente sumiso que obedece, pero la cabeza no le sirve de nada. Durante más de diez años he sido esclavo de la enfermedad sin padecerla, o lo que es lo mismo, de sus achaques"
Miguel Delibes
Su Obra: El camino (1950); Las ratas (1962); Cinco horas con Mario (1966); Los santos inocentes (1981)
miércoles, 17 de marzo de 2010
Resistencia a los inhibidores de tirosino-cinasa en la Leucemia Mielóide Crónica
MECANISMOS DE RESISTENCIA A LOS INHIBIDORES DE
TIROSINA-CINASA EN LA LEUCEMIA MIELOIDE CRÓNICA
El imatinib (IM) constituye el tratamiento de elección en la leucemia mieloide crónica (LMC) en fase crónica (FC). Tras siete años de seguimiento del estudio IRIS, los pacientes presentan una supervivencia global estimada del 86% y una disminución progresiva de la probabilidad de evolución a fase acelerada o crisis blástica1.A pesar de los excelentes resultados obtenidos con IM, aproximadamente un 25% de pacientes van a presentar durante su evolución bien una falta de respuesta inicial al tratamiento (resistencia primaria), una respuesta subóptima, una pérdida de respuesta citogenética o hematológica (resistencia secundaria) o bien una intolerancia al mismo2
Conocer los mecanismos de resistencia que ocasionan la falta de respuesta o la pérdida de la misma nos va a permitir tomar la decisión clínica más adecuada.
Dependiendo de la causa de resistencia, unos pacientes se podrán beneficiar de un aumento de dosis de IM, mientras que en otros estará indicado realizar un cambio a inhibidores de segunda generación (nilotinib o dasatinib) o incluir al paciente en un ensayo clínico con nuevos fármacos.
Mecanismos de resistencia primaria
Cuando tratamos pacientes con LMC en primera FC, la falta de respuesta inicial al tratamiento con IM es más frecuente que la pérdida de respuesta y, a diferencia de los pacientes que presentan una resistencia secundaria, las mutaciones del dominio cinasa de ABL raramente son la causa.En tan sólo un 10-15% de los pacientes con LMC en 1.ª FC tratados en primera línea con IM y que presentan resistencia primaria se detectan mutaciones en el dominio cinasa de ABL3.Dentro de los mecanismos de resistencia primaria, tienen especial interés los implicados en la resistencia a IM de la célula madre quiescente Filadelfia-positiva. Cuando se comparan células madre CD34 positivas,
CD38 negativas con células más comprometidas CD34 positivas y CD38 positivas se observan diferencias que pueden explicar la distinta sensibilidad de las mismas al tratamiento con IM.
Así, las células CD34+ CD38– presentan mayor nivel de expresión de la proteína BCR-ABL y mayor nivel de fosforilación de sustratos que las células CD34+ CD38+. Otro hecho biológico que las diferencia son los distintos niveles de actividad de las proteínas transportadoras de IM. Las células CD34+ CD38– tienen menor nivel de actividad de la proteína OCT1 (introduce IM dentro de la célula) y mayor nivel de actividad de las proteínas ABCB1 y ABCG2 (expulsan IM de la célula) que las células más comprometidas CD34+ CD38+4,5.
La actividad de la proteína transportadora OCT1, la cual introduce IM en el interior celular, ha sido la más estudiada en pacientes con LMC tratados con IM y que presentan resistencia primaria o respuesta subóptima. En aquellos tratados con dosis inferiores a 600 mg de IM y baja actividad de OCT1 sólo un 18% presentaron una respuesta molecular mayor (RMoM) a los 18 meses, frente a un 83% de los los que presentaban una actividad normal de OCT1. Estas diferencias en la respuesta desaparecen cuando los pacientes son tratados con dosis superiores a 600 mg. A diferencia de lo que sucede con IM, el nivel de actividad de OCT1 no influye en la respuesta obtenida cuando los pacientes son tratados con inhibidores de segunda generación (nilotinib o dasatinib)6,7.
Diferentes polimorfismos genéticos de las proteínas transportadoras de IM se han relacionado con el nivel de respuesta alcanzado. Se han estudiado polimorfismos del gen de multirresistencia a drogas (MDR1 o ABCB1) en 90 pacientes con LMC tratados con IM, y se han relacionado con la probabilidad de obtener una RMoM y con las concentraciones plasmáticas de IM.
Los pacientes con el genotipo T1236T consiguieron de forma significativa mayor porcentaje de RMoM y presentaban mayores niveles plasmáticos de IM que los que tenían los genotipos C1236C o C1236T8. La variabilidad en los niveles plasmáticos de IM es otro de los mecanismos más estudiados en pacientes con resistencia primaria o respuesta subóptima. En un subanálisis del estudio IRIS se analizó el valor de los niveles plasmáticos de IM, determinados en el día 29 de tratamiento, en relación con la respuesta obtenida. Los pacientes se dividieron en tres grupos en función del cuartil donde se hallaban sus niveles de IM (Q1 < 647 ng/mL, Q2-Q3 ≥ 647-1170 ng/mL y Q4 > 1170 ng/mL).
Aquellos con niveles comprendidos dentro del grupo Q1 (< 647 ng/mL) presentaron una menor probabilidad de obtener una respuesta citogenética completa (RCyC) durante los 5 años de seguimiento9.
Como causa de resistencia primaria o respuesta sub-óptima, hemos de destacar aquellos mecanismos que son independientes de BCR-ABL y que, por lo tanto, escaparían a la acción de los inhibidores específicos de la tirosina-cinasa BCR-ABL10. El más estudiado es la vía de la SRC cinasa Lyn, la cual se ha visto que puede estar activada, de forma independiente de BCR-ABL, en líneas celulares resistentes a IM y también en un algunos
pacientes con resistencia11
Nuestro grupo está trabajando en los mecanismos epigenéticos implicados en la resistencia al tratamiento con IM; en concreto, en el mecanismo de regulación de la proteína proapoptótica BIM, la cual es mediadora de la acción de IM12. Los pacientes con disminución de la expresión de BIM, debido a metilación de su región promotora, presentan menores niveles de repuesta a IM a los 6, 12 y 18 meses de iniciado el tratamiento, que los pacientes con niveles de expresión normales de BIM13.
Mecanismos de resistencia secundaria o pérdida de respuesta
Las mutaciones en el dominio cinasa de ABL son la causa más frecuente de la pérdida de respuesta hematológica o citogenética. Hasta el momento se han descrito más de 70 mutaciones diferentes en ABL que pueden afectar a 50 aminoácidos diferentes14. La identificación de la mutación responsable de la resistencia nos va a permitir decidir si hemos de aumentar la dosis de IM o cambiar a un inhibidor de segunda generación y, además, a cuál de ellos: nilotinib o dasatinib15.
Las mutaciones F317L, V299L y T315A presentan un alto grado de resistencia al dasatinib, por lo que deberemos optar por el cambio a nilotinib. Sin embargo, si detectamos las mutaciones Y253H/F, E255V/K o la F359, el inhibidor de segunda línea que deberemos utilizar será el dasatinib16,17.
La mutación T315I continúa siendo un problema sin resolver debido a su total insensibilidad al tratamiento con IM, nilotinib o dasatinib. Si detectamos dicha mutación, el paciente deberá ser incluido en un ensayo clínico con nuevos inhibidores o fármacos activos sobre ella, o bien sometido a un trasplante alogénico si reúne las condiciones adecuadas para el mismo18,19
Con el uso secuencial de lo distintos inhibidores de la cinasa ABL, cada vez se describen más casos en los que cambia el estado mutacional en un mismo paciente durante su evolución. Dependiendo del inhibidor empleado y de la clona celular resistente, cambiarán las mutaciones responsables de las pérdidas de respuesta20.
El estudio de mutaciones en pacientes que presentan una RCyC no se recomienda de forma rutinaria, pues hasta ahora carecía de significado clínico21,22. Sin embargo, en un trabajo reciente publicado por el grupo del Hospital Hammmersmith se estudia la presencia de mutaciones durante el seguimiento de 214 pacientes en RCyC, encontrando algunas mutaciones en 10 de ellos (4,7%).
En este trabajo, el hallazgo de mutaciones, sobre todo en la región P-loop, fue predictivo de la pérdida de la RCyC, con un intervalo medio de 20,7 meses (rango: 2,8-49,1 meses) desde que se detecta la mutación. En el análisis multivariante, la detección de una mutación durante el seguimiento de los pacientes en RCyC fue el único factor predictivo independiente de la pérdida de respuesta23. Dentro de los métodos de laboratorio empleados en el estudio de mutaciones, la secuenciación directa de BCR-ABL sigue siendo el método de referencia; la sensibilidad de esta técnica en la detección de una mutación es del 25%, es decir, deben existir al menos un 25% de células portadoras de la mutación para poder ser detectada por secuenciación. Para encontrar unos niveles de mutación de al menos el 25%, el paciente debe encontrarse en recaída citogenética. En otras palabras: si un paciente presenta un ascenso de un logaritmo en los niveles de expresión de BCR-ABL partiendo de un 0,1% (aumenta de 0,1% a 1%), estaría indicado un estudio de mutaciones según las recomendaciones actuales24, pero la secuenciación directa sería incapaz de detectarla debido a su limitada sensibilidad.sensibilidad. Otros métodos más sensibles, como la PCR cuantitativa específica de secuencia (ASO-PCR), la cromatografía (D-HPLC) o la pirosecuenciación, están siendo empleados cada vez con más frecuencia para el estudio de mutaciones25,26. Si bien debe ser comprobado en series más amplias y homogéneas de pacientes, hemos de destacar, por su alta frecuencia, un mecanismo de resistencia recientemente descrito. Se trata de la presencia, en aproximadamente el 60% de los pacientes resistentes estudiados, de un reordenamiento alternativo del gen BCR-ABL, en el que se ha detectado 35 nucleótidos insertados insertados entre el exón 8 y 9 del gen ABL. La importancia clínica de esta anomalía radica en que la proteína BCR-ABL que se genera adquiere una conformación espacial muy parecida a la que adopta la proteína resultante de la mutación T315I. Según los autores, no sólo va a tener importancia clínica detectar este reordenamiento atípico, sino también cuantificar su proporción respecto al reordenamiento normal BCR-ABL27.
Síntesis
1-Actualmente, la mayoría de los enfermos con LMC tratados con IM comienzan el tratamiento en fase crónica precoz y sin haber recibido previamente ningún otro fármaco. En los pacientes con estas características, la resistencia primaria al tratamiento es más frecuente que la resistencia secundaria o pérdida de respuesta, y las mutaciones del dominio cinasa de ABL sólo explican un pequeño porcentaje de las resistencias primarias. Esto implica que los mecanismos de resistencia primaria dependientes del metabolismo del inhibidor, de factores farmacogenéticos, epigenéticos o de la activación de vías independientes de BCR-ABL cada vez tienen mayor trascendencia clínica.2-Las mutaciones de ABL continúan siendo la causa más frecuente de pérdida de respuesta. La identificación de la mutación responsable de la misma nos permitirá
elegir el tratamiento de segunda línea más indicado en este grupo de pacientes, sin olvidarnos de que con el cambio de inhibidor podemos seleccionar otra clona celular distinta de la que condicionó la primera pérdida de respuesta.
3-La tendencia actual, en la que trabajan distintos grupos, es la de establecer perfiles de expresión proteica, genética y epigenética que puedan permitirnos predecir cual será la respuesta individual de cada paciente y su mejor opción terapéutica desde el inicio del tratamiento con inhibidores de BCR-ABL.
thomas mann
Datos publicados sin autorizacion
Datos publicados sin autorizacion
viernes, 12 de marzo de 2010
"Lo importante en la vida no es lo que te ocurre sino cómo enfrentarte a ello."
"Cuando a uno le cae encima una enfermedad grave, las dificultades vienen por todos los lados. Creo que si uno se enfrenta a la enfermedad con decisión, a pesar de las sensaciones de miedo, repulsión, exclusión que pueda tener, si uno hace esto es más fácil superar esta situación"
Joan Manuel Serrat, que por estos días, transita un nuevo desafío que le plantea la vida.
Joan Manuel Serrat, que por estos días, transita un nuevo desafío que le plantea la vida.
jueves, 11 de marzo de 2010
¡Queremos conseguir 5.000 corazones contra la leucemia!
Envíanos tu corazón junto con tu mensaje de esperanza ainfo@fcarreras.es.
La Fundación Josep Carreras quiere conseguir 5.000 corazones contra la leucemia, uno para cada persona a la que diagnostican esta enfermedad cada año en Españamartes, 9 de marzo de 2010
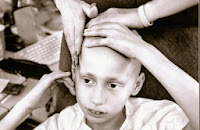
Reportaje Fotográfico por Renné C. Byer - Fotos de intenso impacto emocional, con las que habrá disenso en la exposición
La serie de fotos narra la historia de una madre soltera, Cyndei French, y su hijo Derek, de 11 años, que padeció un tipo de cáncer conocido como neuroblastoma.
El trabajo, dividido en cuatro partes, se publicó en 2007 en el diario The Sacramento Bee. Durante un año, Bayer y una reportera del periódico acompañaron a ambos en su día a día contra la enfermedad.
El trabajo fotográfico de Renée C. Byer ganó el premio Pulitzer en la categoría Reportajes fotográficos; las fotos acompañaron al texto escrito por Cynthia Hubert.
La breve historia personal de Derek. Tal vez desde la inocencia, apostó a hacerlo posible. Y quien duda, que lo logró?
Asociación de Consumidores - SEPA DEFENDERSE
NO deberíamos consumir alimentos que causan cáncer


Su elaboración contiene CICLAMATO DE SODIO, como conservante y edulcorante no nutritivo, PROHIBIDO por la FDA en los EE.UU. por ser causante de CÁNCER, pero no para Sur América.
Te preguntás...¿porqué?
Te preguntás...¿porqué?
Suscribirse a:
Entradas (Atom)