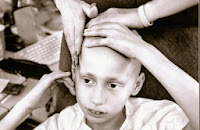
"Cuando a uno le cae encima una enfermedad grave, las dificultades vienen por todos los lados. Creo que si uno se enfrenta a la enfermedad con decisión, a pesar de las sensaciones de miedo, repulsión, exclusión que pueda tener, si uno hace esto es más fácil superar esta situación"
Joan Manuel Serrat, que por estos días, transita un nuevo desafío que le plantea la vida.
Intento integrar en este espacio informes, datos, opiniones, sobre el tratamiento de la Leucemia Mielóide Crónica en particular y del Cáncer en general y compartir las experiencias de vida, discutir los condicionantes socioculturales y medioambientales que determinan los tratamiento que realizan los pacientes. Aspiro a generar un espacio de comunicación con todos aquellos que como yo, realicen tratamientos por enfermedades graves. Sin pretensiones autoreferenciales, me dispongo a compartir con pacientes, familiares y médicos, la palabra, que acompañe este azaroso recorrido.
Transito este tiempo con la enfermedad Leucemia Mielóide Crónica, Cromosoma Ph.+.
viernes, 12 de marzo de 2010
jueves, 11 de marzo de 2010
¡Queremos conseguir 5.000 corazones contra la leucemia!
Envíanos tu corazón junto con tu mensaje de esperanza ainfo@fcarreras.es.
La Fundación Josep Carreras quiere conseguir 5.000 corazones contra la leucemia, uno para cada persona a la que diagnostican esta enfermedad cada año en Españamartes, 9 de marzo de 2010
Reportaje Fotográfico por Renné C. Byer - Fotos de intenso impacto emocional, con las que habrá disenso en la exposición
La serie de fotos narra la historia de una madre soltera, Cyndei French, y su hijo Derek, de 11 años, que padeció un tipo de cáncer conocido como neuroblastoma.
El trabajo, dividido en cuatro partes, se publicó en 2007 en el diario The Sacramento Bee. Durante un año, Bayer y una reportera del periódico acompañaron a ambos en su día a día contra la enfermedad.
El trabajo fotográfico de Renée C. Byer ganó el premio Pulitzer en la categoría Reportajes fotográficos; las fotos acompañaron al texto escrito por Cynthia Hubert.
La breve historia personal de Derek. Tal vez desde la inocencia, apostó a hacerlo posible. Y quien duda, que lo logró?
Asociación de Consumidores - SEPA DEFENDERSE
NO deberíamos consumir alimentos que causan cáncer


Su elaboración contiene CICLAMATO DE SODIO, como conservante y edulcorante no nutritivo, PROHIBIDO por la FDA en los EE.UU. por ser causante de CÁNCER, pero no para Sur América.
Te preguntás...¿porqué?
Te preguntás...¿porqué?
domingo, 28 de febrero de 2010
Dato estadístico
La leucemia es responsable de aproximadamente el 3% de todos los cánceres humanos, con una incidencia mundial de aproximadamente 6 a 10 casos por 100.000 personas y es responsable del 15-20% de todas las leucemias del adulto
viernes, 26 de febrero de 2010
Cuantificacion de la la respuesta al tratamiento de la LMC
Como se establece la respuesta de la LMC a la aplicación de los distintos tratamientos
Remisión o Respuesta Hematológico.
Las pruebas de sangre se pueden usar para ver si un paciente tiene una respuesta hematológica completa.
Es decir que los conteos de glóbulos rojos, glóbulos blancos y plaquetas son normales o prácticamente normales.
Remisión o Respuesta Citológica. FISH
(Se realiza con muestras de sangre perisferica o una biopsia de médula ósea)
Se usa para determinar la respuesta citogenética del paciente es decir, el porcentaje de células de CML que permanecen en el cuerpo.
Clasificación de La RC (respuesta citogenética)
RC Nula: Ph 90% ;
RC Mayor: Ph 60-90;
RC Media: Ph 30-60 %;
RC Minima: Ph 30%;
RC Completa: Ph 0 %
Remisón o Respuesta Molecular - PCR
(Se realiza con muestras de sangre perisferica o una biopsia de médula ósea en caso que RC sea completa )
Se usa para determinar a respuesta molecular del paciente (el grado en que ha disminuido el gen BCR/ABL).
síntesis general, no académica
Thomas Mann
Las pruebas de sangre y médula ósea para la deteccion de LMC.
Un diagnóstico de LMC se realiza a partir de un examen de las células sanguíneas.
Estas pruebas se pueden hacer en el consultorio del médico o en un hospital. Las dos pruebas casi siempre se hacen a la vez.
b-Una aspiración de médula ósea, El paciente primero, recibe medicación para adormecer la piel. Luego, una aguja especial se introduce en el hueso de la cadera del paciente hacia la médula. Se extrae una muestra de células.Extracción de la muestras...
a- Extraccion de sangre
a- Extraccion de sangre
c-Una biopsia de médula ósea es diferente a una aspiración de médula. Primero, el paciente recibe medicación para adormecer la piel. Luego se usa una aguja especial para biopsias para extraer un núcleo del hueso que contiene médula.
Exámenes sobre las muestras...
Por medio del Hemograma
Se mide la cantidad y el tipo de células en la sangre. En la mayoría de los casos, se examinan las células de la sangre y la médula ósea para diagnosticar CML. Con esta enfermedad, la concentración de hemoglobina disminuye y aumenta el conteo de glóbulos blancos, a menudo hasta niveles muy altos. El examen de células sanguíneas teñidas (coloreadas) con un microscopio óptico muestra un patrón característico de los glóbulos blancos: una pequeña proporción de células muy inmaduras (células blásticas leucémicas y promielocitos) y una proporción mayor de glóbulos blancos en proceso de maduración y totalmente maduros (mielocitos y neutrófilos). Las células blásticas, los promielocitos y los mielocitos no están presentes en la sangre de personas sanas.Por medio del análisis citogenético
(Son varias pruebas de laboratorio para examinar los cromosomas de las células con leucemia. Esta prueba ayuda al médico a determinar si el paciente tiene LMC) . La mas usada es la hibridación in situ con fluorescencia (FISH por sus siglas en inglés) se usa para determinar el porcentaje de células de LMC del paciente que permanecen en el cuerpo. Es otro método para identificar células en las que el núcleo contiene cromosomas que tienen la translocación 9;22 característica de la CML. La FISH usa agentes de unión al ADN que son específicos para los fragmentos de ADN de interés, en este caso los genes ABL y BCR.
La sonda para BCR y para ABL se puede marcar con sustancias químicas que emiten un color de luz diferente. El color se puede localizar en el cromosoma en el cual está presente el gen, normalmente el cromosoma 9 para el ABL y el cromosoma 22 para el BCR. Esto permite visualizar el fragmento translocado del cromosoma 9 en su posición anormal en el cromosoma 22. Esta prueba cromosómica para la CML es más sensible que la citogenética convencional, que identifica el cromosoma Ph. Además, la FISH puede detectar la alteración en las células sanguíneas y no requiere un examen de la médula
La sonda para BCR y para ABL se puede marcar con sustancias químicas que emiten un color de luz diferente. El color se puede localizar en el cromosoma en el cual está presente el gen, normalmente el cromosoma 9 para el ABL y el cromosoma 22 para el BCR. Esto permite visualizar el fragmento translocado del cromosoma 9 en su posición anormal en el cromosoma 22. Esta prueba cromosómica para la CML es más sensible que la citogenética convencional, que identifica el cromosoma Ph. Además, la FISH puede detectar la alteración en las células sanguíneas y no requiere un examen de la médula
Por medio de la reacción en cadena de la polimerasa o (PCR por sus siglas en inglés)
Se mide la cantidad y la estructura de los cromosomas. Se examina una muestra de médula ósea para confirmar los hallazgos del análisis de sangre y determinar si hay una anomalía cromosómica. La presencia del cromosoma Ph (un cromosoma número 22 acortado) en las células de la médula, un alto conteo de glóbulos blancos y otros hallazgos característicos de la prueba en la sangre y la médula confirman el diagnóstico de CML.
Un pequeño porcentaje de pacientes con manifestaciones clínicas de CML no tiene un cromosoma Ph citogenéticamente detectable, pero son positivos para la redisposición del BCR en el cromosoma 22.
Datos obtenidos de lecturas de divulgación general
No avalados por académicos
thomas mann
Imatinib....desarrollo del STI-571 y mecanismo de acción
Desde que se descubre la traslocacion que luego, se estableceria produce la LMC....
1960.……. Asociación del cromosoma ph+ a la LMC
1973.…….Descripción de la translocación 9-22
1983.…....Caracterización funcional y molecular de los genes en la fusión oncogénica abl-bcr
1988.…….Desarrollo del inibidor de la tirosinocinasa
Hasta el desarrollo del primer inhibidor de la tirosinaquina
1998.…….Ensayos clínicos de la fase I sti-571
2001...…..sti-571 como tratamiento de elección en pacientes con LMC
Trancurrieron 38 años
Imatinib es el primer inhibidor de la tiroquinasa disponible para uso clínico. Su acción principal radica en bloquear selectivamente la proliferación celular e inducir la apoptosis en las células que expresan cromosoma Philadelphia (Ph+) y albergan la tiroquinasa Bcr-Abl, anomalía causante de la leucemia mieloide crónica (LMC).
La LMC fue el primer cáncer vinculado casualmente a una anomalía genética. En 1969 se observó que un cromosoma anormal se asociaba a esta enfermedad. Se le denominó «cromosoma Philadelphia» por la ciudad en que fue descubierto. Esta anomalía es el resultado de una translocación o intercambio de material genético entre los brazos largos de los cromosomas 9 y 22. El cromosoma Philadelphia está presente en el 95% de los pacientes con LMC, lo que lo convierte en caso patognómico de esta enfermedad. Además, está presente en las estirpes sanguíneas en la LMC, lo que indica que la transformación maligna se origina en la célula madre.
La LMC se caracteriza por la proliferación clonal de células madre mieloides malignas que da lugar a un número excesivo de células mieloides en todas las fases de maduración. Pero, como también hay otras estirpes celulares no mieloides presentes, se considera que es una enfermedad cuyo origen es la célula madre hematopoyética primitiva.
La leucemia es responsable de aproximadamente el 3% de todos los cánceres humanos, con una incidencia mundial de aproximadamente 6 a 10 casos por 100.000 personas. Globalmente la LMC tiene una incidencia de 1-2 casos por 100.000 personas y es responsable del 15-20% de todas las leucemias del adulto.
El nuevo fármaco imatinib actúa sobre la causa molecular de la LMC y es un tratamiento oral eficaz y bien tolerado. Al inhibir sólo la causa específica de la enfermedad, cumple el objetivo del tratamiento dirigido a la causa molecular.
Imatinib está indicado para el tratamiento de los pacientes con LMC en crisis blástica en fase acelerada o en fase crónica después del fracaso del tratamiento con IFN-alfa.
Mecanismo de acción
Imatinib es un derivado de la 2-fenilaminopirimidina. Es una molécula pequeña antagonista con actividad frente a las tirosinquinasas proteínicas y se eligió porque ejerce una inhibición potente y específica de Bcr-Abl.
Imatinib actúa específicamente bloqueando el lugar de unión para el ATP en la quinasa Abl, lo que inhibe la capacidad de ésta para transferir grupos fosfato desde el ATP y residuos de tirosina fosforilados de proteínas sustratos, lo que, a su vez, impide la transducción de las señales de energía necesarias para la proliferación celular y la apoptosis inducida por Abl. De este modo, la vía específica de transducción de señales activada anormalmente en el proceso de transformación leucémica resulta inactivada por imatinib, mientras que las vías normales no se ven afectadas. El Abl natural también es inhibido por imatinib, pero, debido a la redundancia en las vías de transducción de señales, no parece que este fenómeno altere los procesos normales desde el punto de vista clínico.
En ensayos in vitro se determinó la concentración de inhibidor que producía una reducción del 50% de la fosforilación de tirosina. Se ha demostrado que imatinib, además de ser un potente inhibidor de las tiroquinasas intracelulares Abl y Bcr-Abl, inhibe selectivamente otras dos tiroquinasas: el PDGF-R y c-Kit, el receptor del factor de las células madre.
Experimentos realizados in vitro con líneas celulares neoplásicas obtenidas de LMC humana demuestran que imatinib inhibe el crecimiento de las células Ph+ que expresan Bcr-Abl. No tiene un efecto significativo sobre las líneas celulares Bcr-Abl negativas. Cuando se cultivan en presencia de concentraciones crecientes de imatinib, las líneas celulares leucémicas Bcr-abl positivas muestran una inhibición de la proliferación dosis-dependiente, mientras que las líneas celulares tumorales Bcr-Abl negativas no se ven afectadas. Estos datos indican que la inhibición de la actividad tirosinquinasa de Bcr-Abl por parte de imatinib es específica y capaz de invertir el crecimiento de las células leucémicas Bcr-Abl positivas.
Farmacocinética
La farmacocinética de imatinib ha sido evaluada en 591 pacientes y 33 personas sanas en dosis de 25 mg a 1.000 mg. No se alcanzó una dosis máxima tolerada en la LMC. Se analizaron los perfiles farmacocinéticos plasmáticos el día 1 y el día 7 o el día 28, momento en el que las concentraciones plasmáticas habían alcanzado el estado de equilibrio.
La absorción de imatinib es rápida, la concentración plasmática máxima se alcanza en una o 2 horas. La vida media es de 18 a 22 horas aproximadamente, lo que indica que la administración una vez al día es adecuada. Las concentraciones plasmáticas medias aumentan de forma proporcional a la dosis tras la administración de dosis únicas o múltiples de entre 25 mg y 1.000 mg. La cinética no cambia tras la administración de múltiples dosis y la acumulación es de 1,5 a 2,5 veces mayor en el estado de equilibrio cuando se administra una vez al día. La biodisponibilidad absoluta media de las formulaciones orales es > 97% aunque la disponibilidad sistémica varía, con un área bajo la curva de concentración/tiempo de entre el 40 y el 60% tras la administración de una dosis oral. Se cree que los efectos de la ingestión de alimentos o de la edad sobre la absorción del fármaco no son clínicamente significativos.
Hasta el 96% del agente circulante se une a proteínas plasmáticas, especialmente a albúmina y a 1-glucoproteína ácida, con poca unión a las lipoproteínas. Aproximadamente el 81% de imatinib o de sus metabolitos se elimina en 7 días. Imatinib se excreta principalmente por las heces (68%) y una cantidad mucho menor por vía renal (13%). Debe usarse con precaución en pacientes con deterioro hepático.
Inhibición de la transducción de señales con imatinib
Farmacodinamia e interacciones
La respuesta absoluta se relaciona con la dosis usando las cifras de leucocitos como marcador de la actividad farmacodinámica. Se observó una disminución de los leucocitos el día 28 en todos los pacientes tratados con dosis > 400 mg/día.
Las sustancias que inhiben la actividad de la enzima CYP3A4 del sistema del citocromo P450 podrían disminuir el metabolismo y aumentar la concentración sérica de imatinib. En personas sanas, la administración concomitante de imatinib y ketoconazol, un inhibidor de la CYP34A, produjo un aumento significativo de la exposición a imatinib. Las sustancias que inducen la CYP34A podrían aumentar el metabolismo y reducir las concentraciones de imatinib.
La administración concomitante de imatinib y simvastatina aumenta al triple la concentración de ésta, por lo que debe prestarse atención a su administración simultánea. Asimismo, debe evitarse el uso concomitante de paracetamol.
Todavía no se dispone de estudios completos en mujeres embarazadas o en período de lactancia.
Seguridad y eficacia
Imatinib presenta en general una buena tolerancia y casi todos los efectos secundarios no hematológicos fueron de intensidad de grados 1-2. Los efectos secundarios no hematológicos más frecuentes relacionados con este fármaco fueron náuseas o vómitos, síntomas musculosqueléticos (especialmente calambres musculares y mialgias), edema (sobre todo periorbitario) y erupción cutánea. De acuerdo con la toxicidad no hematológica, no se estableció una dosis máxima tolerada de imatinib.
Imatinib supone un avance significativo en el tratamiento de las enfermedades neoplásicas y como primer tratamiento farmacológico que actúa a escala molecular y que se ha diseñado racionalmente para la LMC
En pacientes con LMC en fase crónica se observó una RH, definida como una reducción del 50% de la leucocitosis mantenida durante un mínimo de dos semanas, en todos los pacientes tratados con imatinib. Se observó una respuesta hematológica completa (RHC), definida como cifra normal de leucocitos y plaquetas mantenida durante un mínimo de 4 semanas, en el 98% de los pacientes tratados con > 300 mg/día en comparación con sólo el 38% de los pacientes tratados con dosis menores que 300 mg.
Las RH se produjeron semanas después de iniciar el tratamiento. También se observan RH en pacientes con crisis blástica o leucemia aguda Ph+ sin una relación dosis/respuesta evidente.
En el estudio en fase crónica se alcanzó una RC en el 54% de los pacientes tratados con dosis > 300 mg.
lunes, 22 de febrero de 2010
Derechos de Propiedad Intelectual y Libre Comercio, Ética...
¿Quién puede aportar, información sobre esta compañia?
....en su página en internet, habla de "la responsabilidad social" y dice "dedicarse sistemáticamente a mejorar el acceso a los medicamentos existentes, al mismo tiempo que investigan nuevas terapias para ayudar a las personas que padecen enfermedades desatendidas, con programas que llegan cada año a millones de pacientes de todo el mundo"
¿Ustedes recuerdan? .
En el año 2007 la demanda de Novartis contra la India, por la cual se pretendia recurrir el rechazo de la patente del Glivec y lo que es mas grave, pretendía impugnar la ley de patentes de aquel país, con la consecuencia de impedir por ejemplo, que pacientes HIV del tercer mundo, pudieran recibir retrovirales, obligando a los gobiernos a pagar esos y otros medicamentos al precio que impusieran las multinacionales dueñas de las patentes.
Para que todos recordemos leamos otra vez la nota publicada en el diario PAIS de España: "Los pobres no valemos nada" y en su volanta "Enfermos de cáncer indios temen quedarse sin tratamiento si se prohíben los genéricos"
Otra...
En 2006 en la Argentina otro país del tercer mundo, recuerdan la denuncia de una mujer que trabajaba en una fundación de ayuda a pacientes con leucemia? Denunció a esa entidad y Novartis por “explotación de enfermos de leucemia y sus familiares” a fin de “mantener y posicionar la facturación” de un medicamento. La “maniobra” incluiría el “pago de abogados para que inicien recursos de amparo a las obras sociales que no proveen el medicamento” y “la utilización de los enfermos como instrumentos mediáticos”. El laboratorio Novartis, así acusado, contesta que “jamás pagamos a un abogado para que represente a pacientes” y que “no nos consta que haya habido ninguna indicación de ese medicamento –llamado Glivec– a partir de un recurso de amparo”. La presentación –que se tramita en el fuero penal económico– plantearía por primera vez en un caso concreto la acusación formulada por la Asociación de Agentes de Propaganda Médica (publicada en este diario el 1º de octubre pasado), según la cual “los amparos contra obras sociales son motorizados por los laboratorios y forman parte de la promoción del producto”.
Para los desmemoriados, la denuncia apareció en el diario PAGINA 12 con el titulo: "Como vender remedios caros" y en su bajada decía: "Según una denuncia, NOVARTIS impulsa en pacientes los amparos contra las obras sociales. La empresa niega la acusación."
________________________________________________________________________________________________Para los desmemoriados, la denuncia apareció en el diario PAGINA 12 con el titulo: "Como vender remedios caros" y en su bajada decía: "Según una denuncia, NOVARTIS impulsa en pacientes los amparos contra las obras sociales. La empresa niega la acusación."
...Quién conoce en que derivaron estas causas judiciales?
Thomas Mann
sábado, 20 de febrero de 2010
Historia del tratamiento de la LMC hasta el presente
La leucemia mieloide crónica fue, posiblemente, descrita a principios de siglo XIX.
Durante el siglo XIX
Antes de los años 50 se utilizó radioterapia, también con modesta actividad antineoplásica, pero con mejoría sintomática.
Durante los años 50 se trató con citostáticos convencionales. Específicamente, se utilizó el Busulfán, un agente alquilante oral que disminuía la mieloproliferación, sin modificar la expresión del cromosoma Ph (El cromosoma Ph fue descrito en 1960). El busulfán no incrementó en forma apreciable la supervivencia, pero mejoraba el recuento de glóbulos blancos y disminuía la esplenomegalia en forma importante. Como agente paliativo fue muy apreciado por pacientes y médicos. Como todos los agentes alquilantes, el busulfán aumentaba la leucemogénesis causando una progresión más temprana a leucemia mieloide aguda en algunos pacientes con CML. Otras toxicidades como mielosupresiones prolongadas, y la toxicidad pulmonar, hacen del busulfán un agente de difícil manejo. Posteriormente, se remplazó el busulfán por la hidroxicarbamida (hidroxiúrea), un antimetabolito que inhibe de ribonucleótido reductasa disminuyendo el aporte de desoxiribonucleótidos para la síntes de DNA. La hidroxiúrea es más fácil de utilizar, menos tóxica para el paciente, y sin el potencial leucemogénico de los alquilantes. Al igual que todos los tratamientos previos, la hidroxiúrea no afectaba la expresión del Ph. Sólo modificaba el fenotipo proliferativo. La supervivencia, por lo tanto, no se veía afectada en forma sustancial pues los pacientes evolucionaban hacias las crisis blásticas en forma ineluctable.
En los 80’s, el panorama cambió en forma importante en con la incorporación de dos tecnologías distintas para el manejo de las leucemias: trasplante de médula ósea e interferón alfa.
a-El trasplante alogénico de médula ósea con médula de un donante intrafamiliar histocompatible se convirtió en la única posibilidad de curación para los pacientes con esta enfermedad. El alotrasplante era, y es, una modalidad que no está disponible para todo el mundo pues requiere de donantes histocompatibles: que compartan antígenos de HLA Clase I y II con el receptor. La probabilidad de tener un donante histocompatible varía ampliamente en los diferentes paises, pero está en el orden del 20-70%. La otra limitación del alotrasplante es su toxicidad: aproximadamente el 20% de los pacientes fallecen como resultado de toxicidades asociadas al trasplante. Por todas estas razones, la supervivencia a largo plazo de pacientes con CML alotrasplantados es de tan sólo el 50%.
b-El interferón alfa modificó, por vez primera, la expresión del cromosoma Ph. Causando normalización del hemograma, con resolución de la esplenomegalia (Fenómeno denominado remisión hematológica) y disminuyendo la proporción de metafases en la médula ósea que exhibían el cromosoma Ph (fenómeno denominado respuesta citogenética). Las respuestas citogenéticas completas (no metafases con cromosoma Ph en la médula ósea) se observan en 20-30% de los pacientes con interferón. Se estableció que los pacientes que exhibían respuesta citogenética completa con el interferón tenían una supervivencia mayor que los que no. Con el interferón alfa (con o sin citarabina adicional), se incrementó la supervivencia mediana de pacientes con CML a unos 6-7 años. El interferón alfa causa fiebre, mialgias, astenia, depresión, etc; y requiere de una administración parenteral varias veces por semana. A pesar de esto, el interferón fue un avance real para los pacientes con CML.Entre los 1980’s y el 2000 el tratamiento de los pacientes con CML era: alotrasplante de médula ósea para los pacientes con donante histocompatibles y relativamente jóvenes (menores de 50 años); o interferón para todos los demás. El CML se constituyó en la primera indicación para trasplante alogénico de médula ósea. Como estaban las cosas a finales del siglo XX, el progreso en la terapéutica de la leucemia mieloide crónica había sido dramático: curación de la mitad de los trasplantados e incremento en la supervivencia mediana de los tratados con interferón. Nada mal en comparación con otras enfermedades neoplásicas. Pero la adopción de tratamientos se basaba en la observación más o menos aleatoria de respuestas encontradas con diferentes medicamentos. Este método empírico ha sido el utilizado durante prácticamente toda la corta historia de la oncología
Desde el año 2000, resultado de la incorporación de inhibidores de tirosina kinasa blanco dirigidas al bcr/abl, el pronóstico de los pacientes con CML ha cambiado en forma DRAMÁTICA, convirtiéndose en una enfermedad indolente, con una supervivencia a 5 años del 90%, e incrementando (aproximadamente 5% fallecen de causas no relacionadas con la leucemia). La prevalencia de pacientes con CML está incrementando en forma dramática – simplemente no se están muriendo!!!!.
Los inhibidores de tirosinas kinasas
IMATINIB
El Imatinib es un medicamento oral que se une al bolsillo que liga el ATP de la proteina bcr/abl, impidiendo la fosforilación de sus sustratos, silenciándola. Los estudios preliminares mostraron algunas respuestas en pacientes con fases avanzadas de la enfermedad y se procedió al estudio fase III en pacientes que no habían sido previamente tratados. En este ensayo clínico iniciado en el año 2000 y denominado IRIS se incluyeron 1106 pacientes de 16 paises con CML en fase crónica. Un grupo fue aleatorizado a la terapia convencional (interferón + citarabina) y el otro grupo recibió mesilato de imatinib 400 mg vía oral cada día. Los reportes preliminares presentados en el 2003 con un seguimiento mediano de 19 meses mostraron que los pacientes con imatinib obtenían una mayor respuesta hematológica, citogenética mayor y citogenética completa del orden del 96%, 87% y 76%, respectivamente. Con seguimiento mediano de 5 años se encontró que la respuesta hematológica completa y la citogenética completa fue de 98% y 96%, respectivamente.
DASATINIB
El dasatinib es un inhibidor de mútiples tirosinas kinasas oral que es sustancialmente más potente al inhibir el bcr/abl que el imatinib. Los estudios iniciales con dasatinib en pacientes con falla o intolerancial al imatinib en CML en fase crónica mostraron una respuesta hematológica completa del 90%, con una respuesta citogenética completa del orden de casi 50% (40% en los pacientes con falla al imatinib) cuando recibían dasatinib 70 mg vía oral cada 12 horas. Con esta dosis se encontró mielosupresión importante (especialmente trombocitopenia) y derrame pleural severo en 6% de los pacientes. Estudios subsecuentes muestran que con atenuación de la dosis a 100 mg cada día se obtiene esencialmente la misma respuesta, con disminución de la toxicidad hematológica (Trombocitopenia importante en sólo 22%) y virtual desaparición del derrame pleural (1%, ninguno severo).
NILOTINIB
El nilotinib es otro inhibidor oral del bcr/abl. A diferencia del dasatinib que inhibe múltiples tirosinas kinasas, el nilotinib sólo inhibe el bcr/abl y lo hace con mucha mayor potencia que el imatinib. Es como un “superimatinib”. Como no inhibe del PDGFR no causa sindrome de derrame capilar y no causa derrame pleural. La dosis inicial es de 400 mg vía oral cada 12 horas, que se puede escalar a 600 mg. La respuesta hematológica completa en pacientes que fallaron o no toleraron el imatinib es del 74%. La respuesta citogenética completa es del 34%. Numéricamente, ambos resultados son inferiores a los observados con dasatinib. Pero se deben evaluar los resultados más maduros y las comparaciones directas en ensayos clínicos futuros para sacar conclusiones sobre la relativa eficacia de ambos agentes. El nilotinib parece ser menos tóxico que el dasatinib con mielosupresión leve en 20%, incremento en las enzimas hepáticas en el 5%, elevación de la lipasa pancreática en menos del 5%. La atrición por toxicidad es de aproximadamente 5%.
Publicado por Mauricio Lema Medina
Sin autorización
viernes, 19 de febrero de 2010
15 de Febrero, Día Internacional del Cáncer Infantil
Organizaciones de 61 países de todo el mundo, miembros de la Confederación Internacional de Padres de Niños con Cáncer (ICCCPO), celebran el 15 de Febrero como el DÍA INTERNACIONAL DEL CÁNCER INFANTIL desde el año 2001. El objetivo es la sensibilización y fomentar una mayor calidad de vida para estos niños y niñas.
COMO RECONOCIMIENTO, PUBLICO LA CONVOCATORIA DE ESAS ORGANIZACIONES
Sumate al Efecto Mariposa: Tu pequeño gesto puede lograr grandes cambios para los chicos con cáncer. ADHERI al Requerimiento de la FUNDACION NATALI DAFNE FLEXER
La expresión «cáncer infantil» se refiere a todos los tipos de cáncer que padecen los niños hasta los 14
años.
Se calcula que más de 160.000 niños en todo el mundo son diagnosticados de cáncer cada año y esta
cifra podría ser considerablemente superior. Los datos sobre la incidencia del cáncer infantil en los
países desarrollados son en su mayoría imprecisos. Son necesarios más registros de cáncer por
población para determinar el número real de niños que padecen cáncer.
El 80% de los pacientes infantiles de cáncer viven en los países en desarrollo, y esta proporción
crecerá a medida que se eliminen las enfermedades infecciosas.
En los países desarrollados, tres de cada cuatro niños con cáncer sobreviven al menos cinco años
después de ser diagnosticados. En los países en desarrollo, más de la mitad de los niños
diagnosticados con cáncer tiene probabilidades de morir. La detección tardía y el acceso limitado a
terapias eficaces contra el cáncer tienen como consecuencia que sólo un pequeño porcentaje de
pacientes reciba el tratamiento médico necesario para salvar su vida.
Datos Obtenidos de AEAL (Asociación Española Contra el Cáncer)
Sin Autorización
La guerra en Irak duplica los casos de leucemia infantil
Como si los niños raquies no tuvieran bastante, ahora, desgraciadamente, acaba de darse a conocer un estudio que confirma que los casos de leucemia infantil se han duplicado en 15 años.
1-Los factores ambientales en Basora están detrás de la 'explosión' de casos cáncer infantil
2-Médicos y expertos reconocen que carecen de las medicinas básicas
3-La supervivencia de la leucemia infantil es de un 80% en España. Allí sólo alcanza el 20
Estos datos han salido a la luz gracias al trabajo conjunto de especialistas de la Universidad de Washington (EEUU) y del Hospital Infantil y de Mujeres Al- Basrah (Basora) Ibn Ghazwan, afiliado a la Universidad de Al-Basrah (Basora). Es el único de la región que dispone de tratamiento para el cáncer infantil.
"Basora, al sudeste de Irak, tiene una localización estratégica, donde el Tigris y el Éufrates confluyen formando el Chat el Arab, y a corta distancia de Irán y Kuwait. Esta limitación ha hecho de la región el foco principal de las tres últimas guerras que han sacudido Irak desde 1980 hasta la actualidad", explican los autores de la investigación, liderados por la estadounidense Amy Hagopian, en el último 'American Journal of Public Health'.
2-Médicos y expertos reconocen que carecen de las medicinas básicas
3-La supervivencia de la leucemia infantil es de un 80% en España. Allí sólo alcanza el 20
Estos datos han salido a la luz gracias al trabajo conjunto de especialistas de la Universidad de Washington (EEUU) y del Hospital Infantil y de Mujeres Al- Basrah (Basora) Ibn Ghazwan, afiliado a la Universidad de Al-Basrah (Basora). Es el único de la región que dispone de tratamiento para el cáncer infantil.
"Basora, al sudeste de Irak, tiene una localización estratégica, donde el Tigris y el Éufrates confluyen formando el Chat el Arab, y a corta distancia de Irán y Kuwait. Esta limitación ha hecho de la región el foco principal de las tres últimas guerras que han sacudido Irak desde 1980 hasta la actualidad", explican los autores de la investigación, liderados por la estadounidense Amy Hagopian, en el último 'American Journal of Public Health'.
Por este motivo tanto esta científica como su equipo no dudan en culpar a la guerra del aumento de casos de leucemia infantil en la zona. "El estudio de la naturaleza cancerígena de la exposición a la guerra es difícil en las situaciones caóticas que caracterizan a los conflictos bélicos. Pero se sabe que Basora es una región sacudidad por los incidencios de los pozos petrolíferos, las armas químicas,las municiones de uranio empobrecido, al benceno, a la contaminación del aire y del agua, aunque no disponemos de datos sobre el grado de exposición de los pacientes a todos estos agentes".
Purificación García de Miguel, jefa de la Unidad de Hemato-Oncología y trasplante de Médula Ósea Pediátrica del Hospital La Paz de Madrid, y una de las doctoras españolas que ha tratado a niños iraquíes con cáncer, tampoco duda de que detrás de este vertiginoso aumento de casos de leucemia infantil estén "los factores ambientales a los que han estado expuestos los menores de Basora. Basta con ver en el trabajo el excesivo número de niños pequeños afectados por la enfermedad oncológica para confirmar que es debido a los agentes descritos por los científicos en su investigación".
El estudio documenta los casos de leucemia en niños de cero a 14 años, admitidos en la unidad de oncología pediátrica del Ibn Ghazwan. Los diagnósticos, confirmados en todos los casos por dos hematólogos, se basaron tanto en la hispatología de la médula espinal como en un recuento sanguíneo completo.
Los resultados muestran 698 casos de leucemia en los menores entre 1993 y 2007. En 1993 fueron 15 casos (2, 6 por cada 100.000 menores al año) y 56, en 2007. Pero en 2006 se llegaron a diagnosticar 97. Y los datos resultan más escalofriantes cuando se comparan con los de otros países. En la Unión Europea y en Estados Unidos son cuatro y cinco, respectivamente, por cada 100.000 residentes de corta edad. "En Kuwait son dos, mientras que en Omán son dos o tres por cada 100.000 habitantes adolescentes", reza el ensayo.
En él también se recogen los casos del resto de tipos de cáncer: un total de 114 afectados en 2006. "Estoy segura que debe haber más niños con enfermedad oncológica de distintos tipos, pero no deben de llegar al hopital. Estamos hablando de cifras muy elevadas, en un país donde hay problemas para que los pequeños reciban tratamiento. Y no digo sólo que no tengan acceso a los fármacos más caros, tampoco a la medicación básica, a la barata. En España tenemos tasas de curación de leucemia del 77% al 80% y allí no llegarán al 20%", agrega la especialista de La Paz.
Los autores de la investigación anhelan ahora poder llevar a cabos estudios sobre la etiología de la leucemia "con el fin de tener una oportunidad para prevenirla, especialmente en aquéllos en los que se sospecha un alto riesgo de padecerla".
Purificación García de Miguel, jefa de la Unidad de Hemato-Oncología y trasplante de Médula Ósea Pediátrica del Hospital La Paz de Madrid, y una de las doctoras españolas que ha tratado a niños iraquíes con cáncer, tampoco duda de que detrás de este vertiginoso aumento de casos de leucemia infantil estén "los factores ambientales a los que han estado expuestos los menores de Basora. Basta con ver en el trabajo el excesivo número de niños pequeños afectados por la enfermedad oncológica para confirmar que es debido a los agentes descritos por los científicos en su investigación".
El estudio documenta los casos de leucemia en niños de cero a 14 años, admitidos en la unidad de oncología pediátrica del Ibn Ghazwan. Los diagnósticos, confirmados en todos los casos por dos hematólogos, se basaron tanto en la hispatología de la médula espinal como en un recuento sanguíneo completo.
Los resultados muestran 698 casos de leucemia en los menores entre 1993 y 2007. En 1993 fueron 15 casos (2, 6 por cada 100.000 menores al año) y 56, en 2007. Pero en 2006 se llegaron a diagnosticar 97. Y los datos resultan más escalofriantes cuando se comparan con los de otros países. En la Unión Europea y en Estados Unidos son cuatro y cinco, respectivamente, por cada 100.000 residentes de corta edad. "En Kuwait son dos, mientras que en Omán son dos o tres por cada 100.000 habitantes adolescentes", reza el ensayo.
En él también se recogen los casos del resto de tipos de cáncer: un total de 114 afectados en 2006. "Estoy segura que debe haber más niños con enfermedad oncológica de distintos tipos, pero no deben de llegar al hopital. Estamos hablando de cifras muy elevadas, en un país donde hay problemas para que los pequeños reciban tratamiento. Y no digo sólo que no tengan acceso a los fármacos más caros, tampoco a la medicación básica, a la barata. En España tenemos tasas de curación de leucemia del 77% al 80% y allí no llegarán al 20%", agrega la especialista de La Paz.
Los autores de la investigación anhelan ahora poder llevar a cabos estudios sobre la etiología de la leucemia "con el fin de tener una oportunidad para prevenirla, especialmente en aquéllos en los que se sospecha un alto riesgo de padecerla".
PATRICIA MATEY
Diario EL Mundo
España
Sin Autorizacion
Suscribirse a:
Entradas (Atom)